Ⅲ. 화학 결합과 분자의 세계
1. 화학 결합
1)화학 결합의 성질
물의 전기 분해 장치에 전류를 흘려주면 (-)극에서는 물이 전자를 얻어 수소 기체가 발생하고, (+)극에서는 물이 전자를 잃어 산소 기체가 발생합니다.
이렇게 물이 전자를 얻고 잃으면서 분해가 되는 까닭은 물은 수소와 산소로 이루어진 화합물이며, 두 원자는 전기적 인력에 의해 결합되어 있기 때문입니다.

2)화학 결합의 원리
자연계에 존재하는 물질은 대부분 2개이상의 원자가 결합한 형태로 존재합니다.
예를 들어 과자 봉지속 충전재로 많이 사용하는 질소의 경우 2개의 질소 원자가 결합하여 안정한 형태의 분자를 형성합니다.
그러나 몇가지 원소들은 결합하지 않고 1개의 원자로 존재하는데, 주기율표의 18족 원소들이 대표적인 예시입니다.
주기율표의 18족 원소들은 가장 바깥 전자 껍질에 8개의 전가 채워져 있습니다.
따라서 화학적으로 안정하고, 반응성이 매우 작아 다른원소와 결합을 거의 형하지 않으므르 비활성 기체라고도 합니다.
18족 원소를 제외하고 원소들은 가장 바깥 껍질이 채워지지 않은 생태이므로 8개의 전자를 채워 안정해지려 하는데, 이러한 경향성을 옥텟 규칙이라고 합니다.
원자들은 전자를 주고받거나 공유하여 화학 결합을 형성하면서 옥텟 규칙을 만족합니다.
화학 결합은 서로 결합하는 원자들의 핵과 원자가 전자 사이의 전기적 인력에 의해 일어나며, 이때 전자들이 참여하는 방법에 따라 이온결합, 공유 결합, 금속 결합으로 구분합니다.
01. 이온 결합
1)이온 결합의 형성
염화 나트륨이 형성된느 과정에서 나트륨 원자는 전자 1개를 잃어 나트륨 이온이 되고, 염소 원자는 이 전자를 받아 염화 이온이 됩니다.
이때 두 이온은 서로 반대 전하를 띠고 있어 정전지적 인력이 작용하고, 이렇게 양이온과 음이온 사이의 정전지적 인력으로 형성된 결합을 이온결합이라고 합니다.

이온 결합은 주로 양이온이 되기 쉬운 금속 원소와 음이온이 되기 쉬운 비금속 원소 사이에서 일어납니다.
그렇다면 이온결합이 형성될 때 에너지는 어떻게 변할까?

양이온과 음이온이 서로 접근하면 두 이온 사이에 작용하는 정전기적 인력에 의해 에너지가 점점 감소하다가 이온 사이의 거리가 너무 가까워지면 전자와 전자 사이, 핵과 핵 사이의 반반력에 의해서 에너지가 증가합니다.
이온 결합은 전지적 인력과 반발력이 균형을 이루면서 전체 에너지가 최소가 되는 지점에서 형성됩니다.
2)이온 결합 물질의 성질
이온 결합 물질로는 염화 나트륨 외에 염화 칼슘, 산화 철등이 있습니다. 이러한 이온 결합 물질은 어떤 공통된 성질을 가질까?
- 실온에서 고체 상태의 결정으로 존재, 비교적 단단한다
- 외부에서 힘 가하면 쉽게 쪼개지거나 부서지는 경향 존재(층이 밀리면서 같은 전하를 띠는 이온 사이에 반발력이 작용하기 때문)
- 고체일때는 전기전도성이 없고, 액체나 수용액일때 이온이 자유롭게 이동할 수 있으므로 고체 상태와는 달리 전기 전도성을 나타낸다.
- 양이온 음이온의 정전지적 인력에 의해 강하게 결합하고 있기 때문에 녹는점과 끊는점이 비교적 높다.
02. 공유 결합과 금속 결합
1)공유 결합의 형성
비금속 원소들은 전자를 서로 송유하여 안정한 화합물을 만드는데, 이때 형성하는 결합을 공유 결합이라고 합니다.
공유 결합을 통해 원자가 옥텟 규칙을 만족 할 때 결합에 참여하는 전자 수는 각 원자의 원자가 전자 수에 따라 다릅니다.
산소 원자와 수소 원자가 만나 물 분자를 형성할 때 원자가 전자가 6개인 산소 원자는 원자가 전자가 1개인 수소 원자 2개와 각각 1개의 전자쌍을 공유하면서 옥텟 규칙을 만족합니다.
그렇다면 공유 결합이 형성될 때 에너지는 어떻게 변할까?
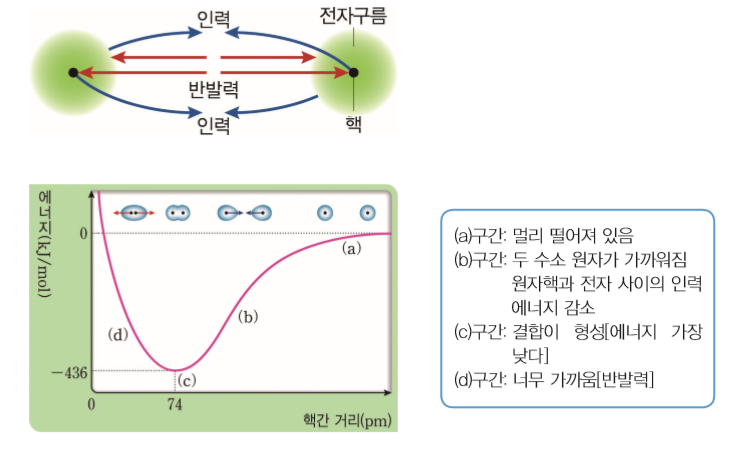
두개의 수소 원자(H)가 결합하여 수소 분자를 형성할 때 수소 원자가 서로 멀리 떨어져 있으면 영향을 미치지 않다가 거리가 점점 가까워지면 핵과 전자 사이에 인력이 작용하여 점차 안정화되고, 에너지가 가장 낮아지는 거리 에서 수소 분자가 형성됩니다.
그러나 원자사이의 거리가 너무 가까워지면 핵과 핵, 전자사이에 반반력이 작용해 에너지가 급격히 증가합니다.
2)공유 결합 물질의 성질
- 이온 결합 물질에 비해 녹는점과 끊는점이 상대적으로 낮다(분자와 분자사이의 인력이 약하기때문)
- 실온에서 주로 액체나 기체로 존재한다.
- 대부분의 공유 결합 물질들은 액체나 수용액 상태에서 자유롭게 이동할 수 있는 전자나 이온이 없어 전기 전도성을 나타내지 않는다.(염화 수소,흑연 제외)
3)금속 결합의 형성
대부분의 금속 원자는 가장 바깥 전자 껍질에 1개 또는 2개의 전자를 가지고 있어 이 전자를 내어주고 쉽게 양이온이 됩니다.
금속 원자에서 빠져 나온 전자들은 어느 금속 양이온에도 속하지 않고 금속 양이온 사이를 자유롭게 움직이는데, 이러한 전자를 자유 전자라고 합니다.
모든 금속 원자가 전자를 내놓지만, 한편으로는 모든 원자가 내놓은 전자를 공유하며 금속 양이온과 자유 전자 사이의 정전기적 인력에 의해 형성되는 결합을 금속 결합이라고 합니다.
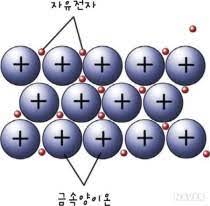
4)금속 결합 물질의 성질
- 전기전도성이 크다(자유전자가 금속양이온 사이를 자유롭게 움직일수 있기 때문에)
- 전성(얊게 펴지는 성질), 연성(가늘게 늘어나는 성질)이 크다
- 열전도성을 가진다
- 대부분 금속 결합 물질은 높은 녹는점을 가지며, 수은을 제외하고 대부분의 금속은 상온에서 고체 상태의 결정으로 존재한다.
'과학 > 화학 1' 카테고리의 다른 글
| 화학1:4-1단원 기초개념(동적평형과 중화 반응-동적 평형, 산과 염기, 중화 반응) (0) | 2022.05.06 |
|---|---|
| 화학1:3-2단원 기초개념(분자의 구조와 성질-결합의 극성, 분자의 구조와 극성) (0) | 2022.05.06 |
| 화학1:2-2단원 기초개념(원소의 주기적 성질-주기율표,원소의 주기적 성질) (0) | 2022.05.05 |
| 화학:2-1단원 기초개념( 원자의 세계-원자의 구조) (0) | 2022.05.05 |
| 화학1:1-2단원 기초개념 (물질의 양과 화학 반응식) (0) | 2022.05.05 |