2. 원소의 주기적 성질
01. 주기율표
1)원소의 분류와 주기율
되베라이너는 화학적 성질이 비슷하고, 물리적 성질은 규칙적으로 변하는 세 원소가 있다는 것을 알고, 성질이비슷한 원소를 3개씩 묶어 세 쌍 원소라고 하였습니다.
이후 뉴랜즈는 원소를 원자량 순서대로 나열했을 때 8번째마다 화학적 성질이 비슷한 원소가 나타난다는 옥타브설을 새롭게 발표했지만 두 이론 다 모든 원소에 들어맞지는 않았다
이후 멜델레예프는 당시 알려진 63종의 원소를 원자량 순서대로 나열했을 때 비슷한 성질의 원소가 주기적으로 나타나는 것을 발견하고, 이미 나열한 원소들과 화학적 성질이 비슷한 원소가 나타나면 그 옆에 배치하였습니다.
이렇게 비슷한 성질의 원소들이 주기적으로 나타나는 것을 주기율이라고 하며, 주기율에 따라 원소들을 배열한 표를 주기율표라고 하였습니다.
2)현대의 주기율표
모즐리는 X선 연구로 원소에서 원자핵의 양전하를 결정하는 방법을 알아내고, 이를 통해 원자 번호를 정하였습니다.
현대 주기율표는 원소들을 원자 번호순으로 배열하다가 화학적 성질이 비슷한 원소가 같은 세로줄에 올 수 있도록 줄을 바꾸고 배열한 표로, 족과 주기로 구성되어 있습니다.

족은 주기율표의 세로줄로 1~18 족, 주기는 주기율표의 가로줄로 1~7주기가 있습니다.
주기율표의 원소들은 금속 원소와 비금속 원소, 준금속 원소로 분류할 수 있습니다.
금속 원소들은 주기율표의 왼쪽과 가운데 부분에 주로 위치하며, 실온에서 모두 고체입니다.
또한, 금속 원소들은 전기 전도성이 좋고, 전자를 잃고 양이온이 되기 쉽습니다.
비금속 원소들은 주기율표의 오른쪽 윗부분에 주로 위치합니다.
비금속 원소들은 전기 전도성이 좋지 않고, 전자를 얻어 음이온이 되기 쉽습니다.
준금속은 비금속과 금속의 중간 성질에 위치합니다.
3)전자 배치와 주기율주기율표에서 같은 족 원소의 경우 화학적 성질이 비슷합니다.
원소의 화학적 성질은 전자 배치와 어떤 관련이 있을까?
원소의 화학적 성질을 좌우하는 것은 원자가 전자입니다.
주기율표의 같은 족 원소들은 원자가 전자 수가 같으므로 화학적 성질이 비슷합니다.
또, 주기율표의 같은 주기 원소는 바닥 상태에서 전자가 들어있는 전자 껍질의 수가 같습니다.
02. 원소의 주기적 성질
1)유효핵전하
원자핵은 (+)전하를 띠는 양성자와 전하를 띠지 않는 중성자로 구성되어 있어 (+)전하를 띠며, 원자핵이 띠고 있는 이 (+)전하를 핵전하라고 합니다.
그렇다면 원자에 있는 전자도 만약 앞에서 가리는 전자가 있다면 (+) 전하를 덜 느끼게 될까?

다전자 원자에서는 전자가 또 다른 전자를 가리므로 양성자에 의한 핵의 전하와 전자가 느끼는 실제 핵전하가 다르며, 전자가 실제로 느끼는 핵전하를 유효 핵전하라고 합니다.
같은 주기에서는 원자 번호가 증가할때 양성자수와 전자수가 모두 증가흐는데, 증가한 핵전하를 효과적으로 가리지 못합니다.
따라서 같은 주기에서 원자 번호가 증가할때 원자가 전자가 느끼는 유효 핵전하는 증가합니다.

2)원자 반지름
현대 원자 모형에 따르면 원자의 경계가 분명하지 않으므로 원자 반지름의 크기를 정확하게 알 수 없습니다.
따라서 일반적으로 원자 반지름은 2개의 같은 원자가 결합했을 때 두핵 사이 거리의 반으로 정의합니다.
그렇다면 원자 반지름에도 주기성이 존재할까?
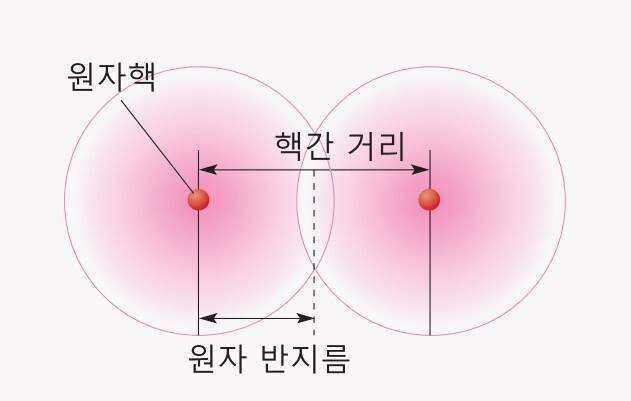
원자 반지름은 전자가 들어 있는 전자 껍질 수와 유효 핵전하의 영향을 받습니다.
같은 족에서는 원자 번호가 증가 할수혹 전자 껍질 수가 증가 하므로 원자 반지름이 커집니다.
같은주기에서는 원자 번호가 증가할수록 유효핵전하가 증가하므로 전자들이 핵 쪽으로 강하게 끌어당겨져 원자 반지름이 작아진다.
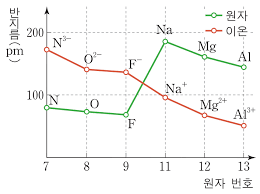
3)이온반지름
원자가 전자를 잃어 안전한 양이온이 되면 전자 껍질 수가 감소하므로 반지름이 작아지고, 원자가 전자를 얻어 안정한 음이온이 되면 전자 수가 많아지면서 전자사이의 반발력이 증가하므로 유효 핵전하가 증가하여 핵과 전자 사이의 인력이 증가하므로 이온 반지름이 작아진다.
4)이온화 에너지
바닥에 붙어 있는 껌을 뗄 때 힘을 가해야 하는 것처럼, 원자핵과 전자 사이에는 인력이 작용하므로 원자에서 전자를 뗴어내려면 에너지가 필요합니다.
기체 상태의 원자로부터 전자 1개를 떼어내는 데 필요한 최소한의 에너지를 이온화 에너지라고 합니다.
이온화 에너지가 작으면 전자를 뗴어 내기 쉬우므로 양이온이 되기 쉽습니다.
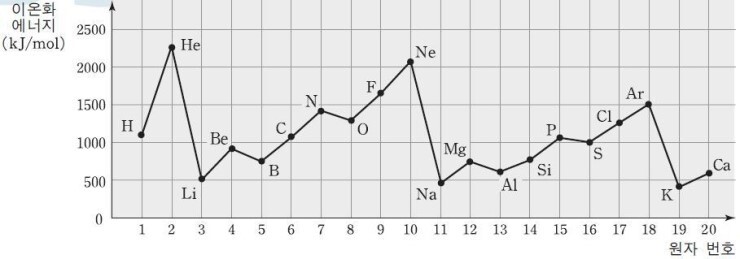
같은 족에서는 원자 번호가 증가할수록 전자 껍질 수가 증가하여 원자핵과 전자 사이의 인력이 작아지므로 이온화 에너지가 감소합니다.
같은 주기에서는 원자 번호가 증가할수록 유효 핵전하가 증가하여 원자핵과 전자 사이의 인력이 커지므로 이온화 에너지가 대체로 증가합니다.
전자가 2개이상인 원자에서는 전자를 순차적으로 떼어낼 수 있습니다.
이때 필요한 에너지를 순차 이온화 에너지라고 하며, 전자를 떼어내는 순서에 따라 차례대로 제 1 이온화 에너지, 제 2 이온화 에너지...라고합니다.
원자에서 전자를 떼어 낼수록 전자사이의 반발력이 감소 하므로 유효 핵전하는 증가합니다.
즉, 전자를 떨어 낼수록 남아있는 전자를 뗴어내기가 어려워지므로 순차 이온화 에너지는 점점 증가 합니다.
또, 순차 이온화 에너지 변화를 살펴 보면 급격하게 증가하는 부분을 볼 수 있는데, 이것은 안쪽 전자 껍질에 있는 전자를 떼어내기가 더 어렵기 때문입니다.
따라서 전자를 연속적으로 뗴어낼 때 전자 껍질이 바뀌면 순차 이온화 에너지는 급격히 증가하며, 이것을 통해 원자의 전자수를 파악할 수 있습니다.
'과학 > 화학 1' 카테고리의 다른 글
| 화학1:3-2단원 기초개념(분자의 구조와 성질-결합의 극성, 분자의 구조와 극성) (0) | 2022.05.06 |
|---|---|
| 화학1:3-1단원 기초개념(화학 결합과 분자의 세계- 화학결합) (0) | 2022.05.05 |
| 화학:2-1단원 기초개념( 원자의 세계-원자의 구조) (0) | 2022.05.05 |
| 화학1:1-2단원 기초개념 (물질의 양과 화학 반응식) (0) | 2022.05.05 |
| 화학1:1-1단원 기초개념 (화학의 첫걸음-화학의 유용성) (0) | 2022.05.05 |