2. 분자의 구조와 성질
01. 결합의 극성
1)전기음성도
원자가 공유 결합을 통해 분자를 형성할 때 두 원자 사이에 공유한 전자쌍을 공유 전자쌍이라고 합니다.
그렇다면 두원자는 이 공유 전자쌍을 똑같이 당길까?
서로 다른 원자들이 공유 결합을 형성할 때도 원자마다 공유 전자쌍을 끌어당기는 힘이 다릅니다.
분자에서 각 원자가 공유 전자쌍을 끌어당기는 정도를 상대적으로 비교하여 정한 값을 전기 음성도라고 합니다
폴링은 플루오린의 전기 음성도를 4.0으로 정하고, 이를 기준으로 다른 원소들의 전기 음성도를 상대적으로 나타냈습니다.

그림은 주기율표상의 각원소들이 가지는 전기음성도 값을 나타낸 것입니다.
전기 음성도는 대체로 같은 주기에서는 오른쪽으로 갈수록 커지고, 같은 족에서는 위로 갈수록 커집니다.

수소나 염소분자와 같이 같은 원자 끼리 결합할떄는 공유 전자쌍을 끌어당기는 힘이 서로 같기 때문에 전자쌍은 어느 한쪽으로 치우치지 않습니다.
이렇게 원자 사이에 전기 음성도 값의 차이가 없어 전자의 치우침이 없는 결합을 무극성 공유 결합이라고 합니다.

그러나 염화 수소나 물, 이산화탄소 분자와 같이 한 원자가 전기 음성도 값이 큰 경우 공유 전자쌍은 전기 음성도 값이 더 큰 원자 쪽으로 치우칩니다.
공유 결합을 이루는 두원자 사이의 전기 음성도 차이에 의해 공유 전자쌍이 한쪽으로 치우치는 결합을 극성 공유 결합이라고 합니다.

극성 공유 결합 분자에서는 전기 음성도 값이 큰 쪽으로 전자가 치우쳐서 부분적으로 음전하와 양전하를 가집니다.
이것을 쌍극자라고 하며, 쌍극자의 크기와 방향을 함께 나타낸 것을 쌍극자 모멘트라고 합니다.
02. 분자의 구조와 극성
1)루이스 전자자점식
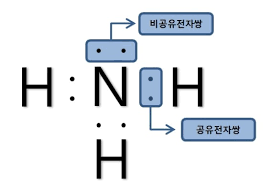
원자 기호 주위에 원자가 전자를 점으로 나타낸식을 루이스 전자점식이라고 합니다.
루이스 전자점식은 원자들이 옥텟 규칙을 만족하기 위해서 몇 개의 전자가 필요한지를 쉽게 파악할 수있게 해줍니다.
2)분자의 루이스 전자점식
2-1)염소 원자는 7개의 원자가 전자를 가지고 있으므로 염소 원자가 결합하여 염소 분자가 될때 옥텟 규칙을 만족하기 위해 전자쌍 1개를 공유하여 결합합니다.
염소분자에서 두염소 원자가 공유하고 있는 전자쌍은 공유 전자쌍이며,각각 의 염소 원자가 단독으로 가지고 있는 전자쌍은 비공유 전자쌍입니다.
루이스 전자점식에서 공유 전자쌍을 선으로 나타낸 화학식을 구조식이라고 하며, 일반적으로 구조식에서는 비공유 전자쌍은 나타내지 않습니다.
수소 분자에서 원자가 전자가 1개인 두 수소 원자는 전자쌍 1개를 공유 하면서 헬륨과 같은 안정한 전자 배치를 가집니다.
원자가 전자가 6개인 두 산소 원자는 전자쌍 2개를 공유하여 네온과 같은 전자 배치를 가지면서 옥텟 규칙을 만족하게 됩니다.
2-2)분자뿐만 아니라 이온이나 여러 화합물도 루이스 전자점식으로 나타낼 수 있습니다.
염화 이온이나 수산화 이온과 같은 이온과 염화 나트륨과 같은 화합물은 다음과 같이 전자점식으로 나타납니다.

3)분자의 구조와 전자쌍 반발 이론
같은 원소로 만들어졌어도 물질의 성질이 다를 수 있는 것은 분자 구조와도 관련 있습니다.
따라서 분자의 구조를 아는 것은 분자의 성질을 예측하는 데 큰도움이 됩니다.
분자에서 3개의 원자가 결합하고 있을 때, 중심 원자의 원자핵과 다른 원자의 원자핵이 이루는 각을 결합각이라고 하고, 결합하고 있는 두원자의 원자핵의 중심 사이의 거리를 결합 길이라고 합니다,
분자에서 결합각과 결합 길이는 분자 구조를 결정하는데 중요한 역할을 합니다.
원자들이 공유결합을 통해 분자를 형성할 때 중심 원자 주위의 전자쌍들은 같은 전하를 띠고 있어 서로 반발력이 작용합니다.
그렇다면 이 전자쌍들이 공간에서 어떻게 배열될 때 반발이 최소화 될수 있을까?
공유 결합 분저에서 중심 원자 주위의 가장 바깥 전자 껍질의 전자쌍들은 반발력을 최소화하기 위해 가능한 한 멀리 떨어져 있으려고 합니다.
이를 전자쌍 반발 이론이라고 하는데, 전자쌍 반발 이론은 다원자 분자의 구조를 예측하는데 매우 유용합니다.
다음은 중심 원자 주위의 공유 전자쌍 수에 따른 전자쌍의 공간 배치 모형을 나타낸 것입니다.

중심 원자 주위에 2개의 공유 전자쌍이 존재한다면 이들은 서로 반대편으로 배열되어야 반발력을 최소화할 수 있습니다.
염화 베릴륨 분자에서 2족원소인 베릴륨 원자 주위에는 2개의 공유 전자쌍이 존재합니다.
2개의 공유 전자쌍이 반발력을 최소화 하기위해서는 서로 반대 방향에 위치해야 하므로 염화 베릴륨의 분자 구조는 직선형이며, 결합각은 180도가 됩니다.
또, 중심원자 주위에 3개의 공유 전자쌍이 존재한다면 이들은 같은 평면에서 120도를 이루면서 삼각형의 꼭짓점을 향하는 배열을 이룰 때 반발력을 최소화할 수 있습니다.
예를들어 삼수소 붕소 분자는 결합각이 120도 이며, 분자의 구조는 평면 삼각형이 됩니다.
중심원자 주위에 4개의 공유 전자쌍이 존재한다면 이들은 109.5도를 이루면서 정사면체의 꼭짓점을 향하는 배열일때 반발력이 최소화됩니다.
예를들어 메테인 분자는 결합각이 109.5도 이며, 분자의 구조는 정사면체입니다.
그렇다면 중심 원자 주위에 비공유 전자쌍이 존재하는 경우에는 분자의 구조가 어떻게 될까?
암모니아 분자에서 15족 원소인 질소 원자 주위에는 3개의 공유 전자쌍과 1개의 비공유 전자쌍이 존재하며, 1개의 비공유 전자쌍에는 결합하고 있는 수소 원자가 없습니다.
비공유 전자쌍과 공유 전자쌍 사이의 반발력은 공유 전자쌍들 사이의 반발력보다 큽니다.
따라서 암모니아 분자에서 결합각은 4개의 공유 전자쌍으로 이루어진 정사면체형의 결합각 109.5도보다 작은 107도이며, 분자 구조는 삼각뿔형이 됩니다.
물분자에서 16족 원소인 산소 원자 주위에는 2개의 공유 전자쌍과 2개의 비공유 전자쌍이 존재합니다.
비공유 전자쌍들 사이의 반발력은 비공유 전자쌍과 공유전자쌍 사이의 반발력보다 크므로 물 분자의 결합각은 암모니아 분자의 결합각보다 더 작은 104.5도이며, 분자의 구조는 굽은형이 됩니다.

4)극성 분자와 무극성 분자
분자 내에 전하가 고르게 분포하여 쌍극자 모멘트의 합이 0인 분자를 무극성 분자라고 합니다.
이와 달리 분자 내에 전하 분포가 고르지 않아 쌍극자 모멘트의 합이 0이 아닌 분자를 극성분자라고 합니다.

극성 분자는 가는 줄기에 (+)나 (-)로 대전된 물체를 가져가면 대전체에 끌리는 성질을 가지고 있다
이것은 극성 분자내에 부분적인 음전하 또는 양전하르 띠는 부분이 대전체에 끌리기 때문입니다.
5)분자의 구조와 극성
이원자 분자의 경우는 분자의 극성 유무를 쉽게 판단할 수 있습니다.
수소분자나 염소 분자와 같이 전기 음성도가 같은 원자들로 이루어진 이원자 분자는 무극성 공유 결합을 하므로 무극성 분자입니다.
분대로 염화 수소와 같이 전기 음성도가 다른 원자들로 이루어진 이원자 분자는 극성 공유 결합을 하므로 극성 분자입니다.
이원자 분자와 갈리 3개 이상의 원자를 가진 다원자 분자의 경우에는 극성 공유 결합으로 이루어진 분자도 분자 구조에 따라 극성 분자일수도 있고, 무극성 분자 일수도 있습니다.
플루오린화 분소 분자에서 플루오린 원자는 붕소 원자보다 전기 음성도가 크므로 B-F 결합은 극성 공유 결합이지만 플루오린화 붕소는 무극성 분자입니다.이것은 붕소 원자를 중심으로 세 개의 플루오린 원자가 대칭적으로 존재해 쌍극자 모멘트의 합이 0이 되기 때문입니다.
6)극성 분자와 무극성 분자의 성질서로 잘 어울리지 못하는 관계를 흔히 물과 기름 사이 라고 합니다.이것은 물과 기름이 서로 잘 섞이지 않기 때문에 나온 말인데, 물과 기름이 서로 잘 섞이지 않은 까닭은 무엇일까?
극성분자와 무극성 분자는 여러 가지 성질의 차이를 나타냅니다.
극성분자는 분자량이 비슷할 때 무극성 분자에 비해 녹는점 끊는점이 높습니다.
또, 극성 분자는 극성 분자와 잘 섞이고, 무극성 분자는 무극성 분자와 잘 섞이며, 극성 분자와 무극성 분자는 서로 잘 섞이지 않습니다.
예를 들어, 물과 같이 극성이 매우 큰물질은 에탄올과 같이 극성인 물질과 잘 섞이며, 염화 나트륨이나 황산구리와 같은 이온성 물질을 잘녹입니다.
헥세인과 같이 극성이 매우우 작은 물질은 기름 등과 같이 극성이 작은 물질과 잘 섞이고, 물처럼 극성이 큰 물질과는 잘 섞이지 않습니다.
'과학 > 화학 1' 카테고리의 다른 글
| 화학1:4-2단원 기초개념(산화 환원 반응, 화학 반응과 열) (0) | 2022.05.07 |
|---|---|
| 화학1:4-1단원 기초개념(동적평형과 중화 반응-동적 평형, 산과 염기, 중화 반응) (0) | 2022.05.06 |
| 화학1:3-1단원 기초개념(화학 결합과 분자의 세계- 화학결합) (0) | 2022.05.05 |
| 화학1:2-2단원 기초개념(원소의 주기적 성질-주기율표,원소의 주기적 성질) (0) | 2022.05.05 |
| 화학:2-1단원 기초개념( 원자의 세계-원자의 구조) (0) | 2022.05.05 |