2. 산화 환원 반응
01. 산화 환원 반응
1)산소와 산화 환원
어떤 물질이 산소와 결합하는 화학 반응을 산화 반응이라고 합니다.
로켓의 수소 연료나 천연가스의 메테인이 연소하면서 빛과 열을 내는 반응과 철이 공기 중에서 녹스는 반응 모두 산소와 결합하는 산화 반응입니다.
또, 산화 반응은 우리 몸속이나 식물의 내부에서도 일어납니다.
우리 몸속 탄수화물이 호흡을 통해 산소와 만나 분해되면서 에너지를 만들 때, 식물이 포도당을 산소와 반응 시켜 호흡할 때도 산화 반응이 일어납니다.
그렇다면 반대로 산소를 잃는 반응에는 어떤것들이 있을까?
광합성은 식물이 빛에너지를 이용하여 이산화 탄소와 물로부터 포도당과 산소를 생성하는 과정입니다.
이때 이산화 탄소는 산소를 잃으면서 포도당으로 되는데, 이렇게 어떤 물질이 산소를 잃는 화학 반응을 환원 반응이라고합니다.
산업이나 우리 생활의 많은 부분에서 유용하게 사용되는 철은 공기 중의 산소와 쉽게 반응하기 때문에 자연에서 철 자체를 존재하지 않고 대부분 산소와 결합된 형태로 존재합니다.
따라서 순수한 철을 얻기 위해서는 산소를 제거하는 과정을 거쳐야하는데, 이 과정에서 환원 반응을 이용합니다.

한 물질이 산소를 잃고 환원되면 다른 물질이 그산소를 얻어 산화 됩니다.
검은색의 산화 구리를 탄소 가루와 반응시켜 순수한 구리를 얻는 과정에서 산화 구리가 구리로 환원되는 반응과 탄소가 이산화 탄소로 산화되는 반응은 함께 일어납니다.
즉, 산화 반응과 환원 반응은 항상 동시에 일어납니다.
2)전자와 산화 환원
철은 공기 중의 산소에 의해 부식이 일어나기도 하지만 바닷물과 만나면 더 빨리 부식이 일어납니다.
이 때문에 바다를 향해하는 배에 철의 부식을 막기 위해 아연 조각을 부착합니다.
그렇다면 바닷물은 어떻게 철을 더 빨리 부식 시키는 걸까? 또, 배에 부착된 아연은 어떤 원리로 철의 부식을 방지하는 걸까?
산소와 결합하는 반응에서 산소는 대부분의 원소보다 전기 음성도가 큽니다.
따라서 산화된 원소의 원자는 산소에 전자를 잃었다고 볼수 있으며, 이처럼 화학 반응에서 전자를 얻고 잃는 것으로도 산화 환원 반응을 정의 할 수 있습니다.
어떤 물질이 전자를 잃으면 산화 반응, 반대로 전자를 얻으면 환원 반응이라고 합니다.
전자의 이동은 전자를 주는 물질과 받는 물질 사이에서 일어나므로 전자의 이동에 의한 산화 환원 반응 역시 동시에 일어납니다.

푸른색 황산 구리 수용액에 아연판을 넣으면 아연은 전자를 잃고 아연 이온으로 산화되어 용액 속에 녹아 들어가고, 용액 속의 구리 이온은 전자를 얻어 구리로 환원되면서 용액의 색이 옅어집니다.
배에 아연을 부착해 부식을 방지하는 것도 이러한 금속의 산화 환원 반응을 이용한 것 입니다.
철보다 반응성이 큰 아연이 먼저 산화 되면서 배의 부식이 방지됩니다.
3)산화수와 산화 환원
연소반응과 금속과 금속 이온의 반응에서는 산소나 전자를 주고받으므로 쉽게 산화 환원 반응을 구분할 수 있습니다.
그러나 물이나 암모니아 등과 같이 전자를 공유하여 물질을 생성하는 반응에서는 어떻게 산화 환원을 구분할 수 있을까?
예를 들어, 암모니아 분자가 생성될 때 질소와 수소의 전기 음성도 차이에 의해 전자쌍은 질소 쪽으로 치우치게 됩니다.
이때 수소가 전자를 잃지는 않지만 질소 쪽으로 수소의 전자가 치우치게 되면서 수소는 산화되고, 질소는 환원됩니다.

그리고 이렇게 여러 화학 반응에서 산화 환원을 좀더 쉽게 구분하기 위해 전기 음성도가 더 큰 원자로 공유 전자쌍이 완전히 이동한다고 가정하고, 이때 원자가 갖는 전하의 수를 산화수로 정하였습니다.
일반적으로 원자나 이온의 산화수를 정하는 규칙은 다음과 같습니다.
산화수 규칙
- 화합물에서 원자들의 산화수의 합은 0이며, 이온인 경우 산화수의 합은 이온의 전하량과 같다
- 화합물에서 H를 제외한 1족 원소의 원자는 +1의 산화수를 , 2족 원소의 원자는 +2의 산화수를 가진다
- 화합물에서 F은 -1의 산화수를 가진다
- 거의 모든 화합물에서 H는 +1의 산화수를 가진다.(단, NaH과 같은 금속 수소화물의 경우에는 -1의 산화수를 가진다)
- 거의 모든 화합물에서 O는 -2의 산화수를 가진다.(단, OF2에서는 +2의 산화수를 가지고, H2O2에서는 -1의 산화수를 가진다)
산화수 규칙을 이용하면 공유 결합 물질을 포함하는 산화 환원 반응을 쉽게 설명 할 수 있습니다.
화학 반응 전후에 각 원소의 산화수를 확인하고, 산화수가 증가하면 산화, 산화수가 감소하면 환원된 것입니다.
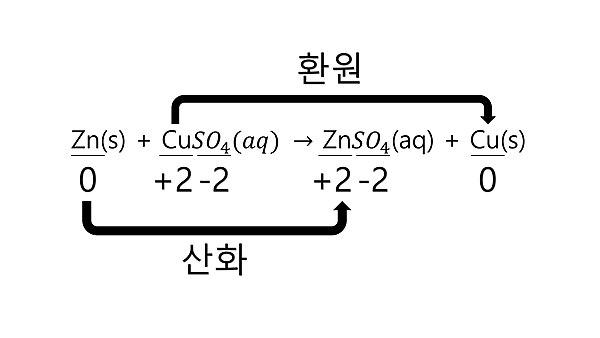
산화와 환원 반응은 동시에 일어나므로 산화 환원 반응에서 한 원자의 산화수가 증가하면 다른 원자의 산화수가 감소합니다.
따라서 환원되는 물질은 다른 물질을 산화 시키므로 산화제라고 하고, 반대로 산화가 되는 물질은 다른물질을 환원 시키므로 환원제라고합니다.
어떤 물질이 산화제 혹은 환원제로 작용하는지는 반응하는 물질에 따라 결정되므로 같은 물질이라도 산화제로도 작용할 수 있고, 환원제로도 작용 할 수 있습니다.
4)산화 환원 반응식
화학 반응식에서의 양적 관계와 마찬가지로 산화 환원 반응에서도 산화 환원 반응식의 계수를 통해 산화된 물질과 환원된 물질의 양적 관계를 알 수 있습니다.

02. 화학 반응과 열
1)화학 반응에서의 에너지 변화
물질이 연소할 때와 같이 화학 반응이 일어날 때 열이 발생하는 경우가 존재하는데, 이열은 어디에서 오는 걸까?
염산과 수산화 나트륨이 반응하면 열이 발생하는데, 이런 반응을 발열 반응이라고 합니다.
발열 반응에서는 반응물이 생성물로 변하면서 에너지가 작아지고, 반응물과 생성물이 가지고 있었던 에너지 차이만큼을 열로 방출해 주위 온도가 올라갑니다.
물질이 타는 연소 반응을 포함해 금속의 산화 반응, 금속과 산의 반응, 산과 염기의 중화 반응과 산의 용해 반응 등이 발열 반응에 해당합니다.

질산 암모늄이 물에 용해될 때는 열이 흡수되는데, 이런 반응을 흡열 반응이라고 합니다.
흡열 반응에서는 반응물이 생성물로 변하면서 에너지가 커지고, 반응물과 생성물이 가지고 있던 에너지 차이만큼의 열을 흡수해 주위 온도가 내려갑니다.
탄산수소 나트륨의 열분해 반응과 수산화 바륨과 염화 암모늄의 반응 등이 흡열 반응에 해당합니다.

화학 반응 과정에서 출입하는 에너지는 우리생활의 다양한 분야에서 활용되고 있습니다.
연료의 연소 반응은 난방이나 취사에 이용하고, 철 가루의 산화 반응은 주머니 난로에 이용합니다.
산화 칼슘이 물과 반응해 발생하는 열은 즉석 조리 식품에 많이 이용합니다.
음식을 차게 보관하거나 팔 다리가 부었을 때 사용하는 냉각 팩은 질산 암모늄의 용해 반응을 이용한 것입니다.
'과학 > 화학 1' 카테고리의 다른 글
| 수능 하루전에 봐야하는 화학 찍기 tip (0) | 2023.03.26 |
|---|---|
| 화학1:4-1단원 기초개념(동적평형과 중화 반응-동적 평형, 산과 염기, 중화 반응) (0) | 2022.05.06 |
| 화학1:3-2단원 기초개념(분자의 구조와 성질-결합의 극성, 분자의 구조와 극성) (0) | 2022.05.06 |
| 화학1:3-1단원 기초개념(화학 결합과 분자의 세계- 화학결합) (0) | 2022.05.05 |
| 화학1:2-2단원 기초개념(원소의 주기적 성질-주기율표,원소의 주기적 성질) (0) | 2022.05.05 |